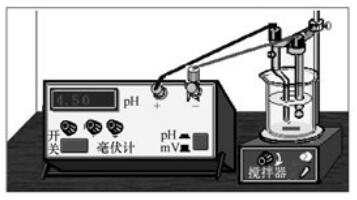
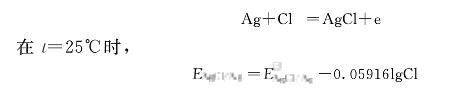目前酸度計(jì)種類、型號(hào)很多,但基本構(gòu)造都相似,都主要由指示電極、參比電極、被測(cè)液、導(dǎo)線連接組成一個(gè)原電池裝置,工作裝置如下圖所示。
1.參比電極
在工作電池中,電位恒定不變的電極稱為參比電極。參比電極是決定指示電極電位的重要因素。的參比電極是標(biāo)準(zhǔn)氫電極,但于其制作比較麻煩,實(shí)際應(yīng)用不多。常見的參比電極是甘電極和銀-氯化銀電極。
(1)甘汞電極是由汞(Hg)和甘汞的糊狀物裝入一定濃度的溶液中構(gòu)成的。
甘汞電極(參比電極)的特點(diǎn)是電位值固定不變,其電極反應(yīng)式如下:

電位在t=25℃時(shí)表達(dá)式為:

其中為標(biāo)準(zhǔn)甘汞電極電位值。由上式可知,當(dāng)t一定時(shí),甘汞電極的點(diǎn)位值取決于KC1溶液中CI-濃度。C1-汞電極中氯化鉀溶液常用的濃度有三種,每種對(duì)應(yīng)的甘汞電極的電極電位如下:

(2)銀-氯化銀電極
也是一種廣泛應(yīng)用的參比電極,它是將銀絲表面鍍上一層氯化銀,侵入到用氯化銀飽和的一定濃度的氯化鉀溶液中,其電極反應(yīng)為:
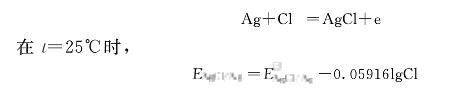
由上式可知,當(dāng)l一定時(shí),銀-氯化銀電極的點(diǎn)位置也取決于KC1溶液中的C1-濃度,銀-氯化銀電極中氯化鉀溶液常用的濃度有三種,每種濃度對(duì)應(yīng)的銀-氯化銀電極的電位如下:

2.指示電極
指示電極的電位隨待測(cè)離子的濃度的變化而改變。為避免共存離子的干擾,要求指示電極對(duì)其響應(yīng)離子應(yīng)具有較高的選擇性。另外,指示電極還應(yīng)具有靈敏度高、測(cè)量濃度范圍寬、響應(yīng)速度快等特點(diǎn)。按結(jié)構(gòu)和原理的不同,可將指示電極分為金屬-金屬離子電極、金屬-金屬難溶鹽電極、惰性金屬電極和離子選擇性電極等。在直接電位法測(cè)定溶液pH中,常見的是離子選擇性電極中的pH玻璃電極。
(1)pH玻璃電極的構(gòu)造如圖所示。它的主要部分是一個(gè)玻璃泡,泡的下半部為特殊材料組成的玻璃薄膜。膜厚為30~100μm。在玻璃泡中裝有O.lmol/LHCl溶液作為內(nèi)參比溶液(或稱為內(nèi)充液),內(nèi)充液中插入一根銀-氯化銀電極作為內(nèi)參比電極。內(nèi)參比電極的電位是恒定的,與被測(cè)溶液的PH無(wú)關(guān)。玻璃電極作為指示電極,其作用主要在玻璃膜上。
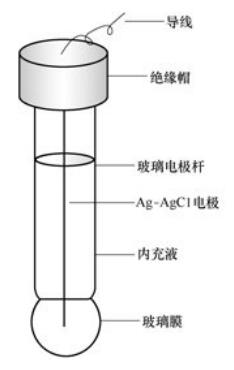
(2)膜電位當(dāng)玻璃電極作為指示電極浸人被測(cè)溶液時(shí),玻璃膜處于內(nèi)部溶液和試樣溶液之間,這時(shí)跨越玻璃膜產(chǎn)生一電位差△EM,這種電位差稱為膜電位,它與氫離子活度之間的關(guān)系符合能斯特公式:

(3)不對(duì)稱電位由式可見,當(dāng)ch試=ch內(nèi)時(shí),厶EM應(yīng)為零。但實(shí)際上測(cè)量表明并不等于零,跨越玻璃膜仍存在一定的電位差,這種電位差稱為不對(duì)稱電位。當(dāng)玻璃電極在水溶液中長(zhǎng)吋間浸泡后,可使不對(duì)稱電位達(dá)到恒定值,合并于式的常數(shù)K中。
(4)玻璃電極的電位玻璃電極具有內(nèi)參比電極,通常是銀-氯化銀電極,其電位是恒定的,與待測(cè)pH無(wú)關(guān)。所以玻璃電極的電位值應(yīng)是內(nèi)參比電極和膜電位之和。
玻璃電極的優(yōu)點(diǎn)是對(duì)H+有高度的選擇性,使用范圍廣,不受氧化劑、還原劑影響,適用于有色、渾濁或膠態(tài)溶液的pH測(cè)定及具有響應(yīng)快(達(dá)到平衡快)、不沾污試液的特點(diǎn)。但由于膜太薄,不能用于含F(xiàn)-的溶液,并且電極電阻高。玻璃電極的pH測(cè)量范圍一般為1~10。當(dāng)試液PH
標(biāo)簽:
酸度計(jì)